考试知识点1 化学反应速率
1.化学反应速率基本定义
用单位时间内反应物浓度的降低或生成物浓度的增加来表示。常用单位为mol(Ls)-1或mol(Lmin)-1
说明:
(1)固体、纯液体在反应中可视为浓度不变,故一般不需要固体或纯液体表示反应速率。
(2)反应速率一般是指某段时间内的平均速率,非即时速率,不可以为负数。(立刻点标题下蓝字高中化学关注可获得更多学习技巧、干货!)
2.化学反应速率的规律
同一反应,用不同物质表示的速率之比,等于化学方程式中化学计量数之比。
近几年的高考考试题,在涉及化学反应速率的要点时,主如果借助化学反应速率的规律,完成下述需要:
1.在一个反应中,由一种物质的反应速率,换算为其他物质的反应速率。
2.比较同一反应在不一样的条件下,用不同物质表示的反应速率的相对大小。
3.由速率之比写出有关方程式
现举例说明如下:

考试知识点2影响化学反应速率的原因
1.内在原因(主要原因)
反应物的性质
2.外在原因
(1)浓度:在其他条件不变时,增大反应物的浓度,化学反应速率增大。因为固体、纯液体在反应中可视为浓度不变,故增加其量并不可以改变反应速率。
(2)温度:在其他条件不变时,升高温度,化学反应速率增大。
(3)压强:在其他条件不变时,对于有气体参加的反应,增大压强,化学反应速率增大。
(4)催化剂:在其他条件不变时,加入催化剂,化学反应速率增大。
(5)其他:光、电磁波、反应物颗粒的大小等也会干扰反应速率。
1.压强对速率的影响,是通过改变气体的浓度来达成的,故一般意义上的增大压强是指压缩气体的体积。对于气体反应体系应该注意以下几个问题。

2.化学反应速率与化学平衡的关系
(1)改变温度,对吸热反应速率的影响,一直超越对放热反应速率的影响:当升高温度时,吸热反应速率增大的倍数>放热反应速率增大的倍数,故升温化学平衡向吸热方向移动;当减少温度时,吸热反应速率减小的倍数>放热反应速率减小的倍数,故降温化学平衡向放热方向移动。
(2)对有气体参加的化学反应,改变压强,对气体体积之和大的一侧的反应速率的影响,一直超越对气体体积之和小的一侧的反应速率的影响:当增大压强时,气体体积之和大的一侧的反应速率增大的倍数>气体体积之和小的一侧的反应速率增大的倍数,故加压化学平衡向气体体积之和小的一侧移动;当减小压强时,气体体积之和大的一侧的反应速率减小的倍数>气体体积之和小的一侧的反应速率降低的倍数,故减压化学平衡向气体体积之和大的一侧移动。
(3)用催化剂,正、逆反应速率增加或减小的倍数相同,故化学平衡不移动。
3.化学要点多,而理综试题化学高考考试题的题量较少,所以化学高考考试题每一道题涉及的要点都比较多。综合考虑各种原因对反应速率的影响进行命题,符合这一命题趋势。
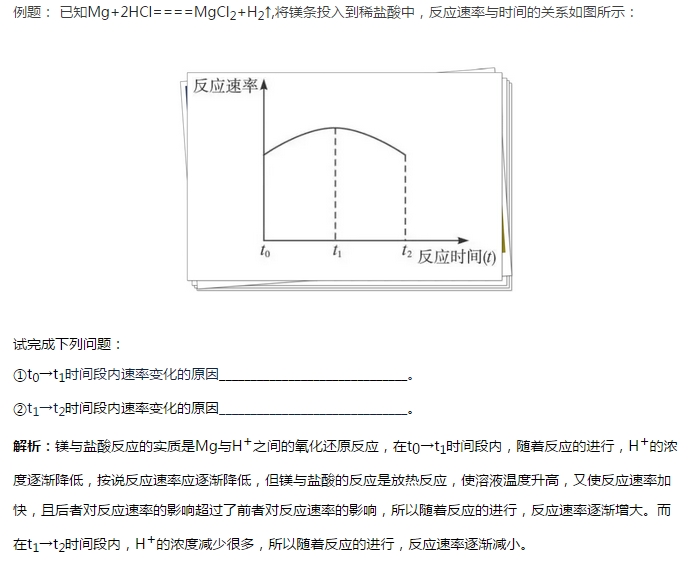
考试知识点3化学平衡
1.定义:
在肯定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组成成分的含量维持不变的状况叫化学平衡状况。
2.特征:
等处于密闭体系的可逆反应,化学平衡状况打造的条件是正反应速率和逆反应速率相等。即v(正)=v(逆)O。这是可逆反应达到平衡状况的要紧标志。
定当肯定条件下可逆反应一旦达平衡(可逆反应进行到最大的程度)状况时,在平衡体系的混合物中,各组成成分的含量(即反应物与生成物的物质的量,物质的量浓度,水平分数,体积分数等)维持肯定而不变(即不随时间的改变而改变)。这是判断体系是不是处于化学平衡状况的要紧依据。
动指定化学反应已达化学平衡状况时,反应并没停止,事实上正反应与逆反应一直在进行,且正反应速率等于逆反应速率,所以化学平衡状况是动态平衡状况。
变任何化学平衡状况均是暂时的、相对的、有条件的(与浓度、压强、温度等有关)。而与达平衡的过程无关(化学平衡状况既可从正反应方向开始达平衡,也可以从逆反应方向开始达平衡)。当外面条件变化时,原来的化学平衡即被打破,在新的条件不再改变时,在新的条件下打造起新的化学平衡。新平衡时正、逆反应速率,各组成成分的含量均与原平衡不同。
3.化学平衡常数

考试知识点4平衡移动原理
假如改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向可以减弱这种改变的方向移动。它是浓度、压强和温度等外面条件对平衡移动影响的概括和总结,只适用于已经达到平衡状况的可逆反应,未处于平衡状况的体系不可以用此原理剖析,但它也适用于其他动态平衡体系,如溶解平衡、电离平衡和水解平衡等。催化剂可以同等程度地增加正反应速率和逆反应速率,因此它对化学平衡的移动没影响。
考试知识点5有关化学平衡的基本计算
(1)物质浓度的变化关系
反应物:平衡浓度=起始浓度-转化浓度
生成物:平衡浓度=起始浓度+转化浓度
其中,各物质的转化浓度之比等于它们在化学方程式中物质的计量数之比。

(5)化学平衡计算的重点是准确学会有关的基本定义及它们相互之间的关系。化学平衡的计算步骤,一般是先写出有关的化学方程式,列出反应起始时或平衡时有关物质的浓度或物质的量,然后再通过有关的转换,分别求出其他物质的浓度或物质的量和实际转化的比例。概括为:打造解题模式、确立平衡状况方程。说明:
①反应起始时,反应物和生成物可能同时存在;
②因为起始浓度是人为控制的,故不一样的物质起始浓度可能不是化学计量数比,若反应物起始浓度呈现计量数比,则隐含反应物实际转化的比例相等,且平衡时反应物的浓度成计量数比的条件。
③起始浓度,平衡浓度未必呈现计量数比,但物质之间是按计量数反应和生成的,故各物质的浓度变化肯定成计量数比,这是计算的重点。
考试知识点6化学反应速率化学平衡图像剖析
第一要看了解横轴和纵轴意义(尤其是纵轴。表示实际转化的比例和表示反应物的百分含量状况就完全相反)与曲线本身属等温线还是等压线(当有多余曲线及两个以上条件时,应该注意定一议二);然后找出曲线上的特殊点,并理解其含义(如先拐先平);再依据纵轴随横轴的变化状况,断定曲线正确走势,以淘汰错误的选项。具体状况如下:
(1)对于化学反应速率的有关图像问题,可按以下的办法进行剖析:
①认清坐标系,搞清纵、横坐标所代表的意义,并与有关的原理挂钩。
②看清起点,分清反应物、生成物,浓度减小的是反应物,浓度增大的是生成物一般生成物多数以原点为起点。
③抓住变化趋势,分清正、逆反应,吸、放热反应。升高温度时,v(吸)v(放),在速率-时间图上,应该注意看清曲线是连续的还是跳跃的,分清渐变和突变,大变和小变。比如,升高温度,v(吸)大增,v(放)小增,增大反应物浓度,v(正)突变,v(逆)渐变。
④注意终点。比如在浓度-时间图上,必须要看清终点时反应物的消耗量、生成物的增加量,并结合有关原理进行推理判断。
(2)对于化学平衡的有关图像问题,可按以下的办法进行剖析:
①认清坐标系,搞清纵、横坐标所代表的意义,并与勒夏特列原理挂钩。
②紧扣可逆反应的特点,搞清正反应方向是吸热还是放热,体积增大还是减小、不变,有无固体、纯液体物质参加或生成等。
③看清速率的变化及变化量的大小,在条件与变化之间搭桥。
④看清起点、拐点、终点,看清曲线的变化趋势。
⑤先拐先平。比如,在实际转化的比例-时间图上,先出现拐点的曲线先达到平衡,此时逆向推理可得该变化的温度高、浓度大、压强高。
⑥定一议二。当图像中有三个量时,先确定一个量不变再讨论另外两个量的关系。
特别提醒:
1.等效平衡:在两种不一样的初始状况下,同一个可逆反应在肯定条件(定温、定容或定温、定压)下分别达到平衡时,各组成成分的物质的量(或体积)分数相等的状况。在恒温恒容条件下,打造等效平衡的一般条件是:反应物投料量相当;在恒温恒压条件下,打造等效平衡的条件是:相同反应物的投料比相等。
2.平衡移动的思维基点
(1)先同后变,进行判断时,可设置相同的平衡状况(参照标准),再依据题设条件察看变化的趋势;
(2)不为零原则,对于可逆反应而言,无论改变任何外部条件,都不可能使其平衡体系中的任何物质浓度变化到零。

